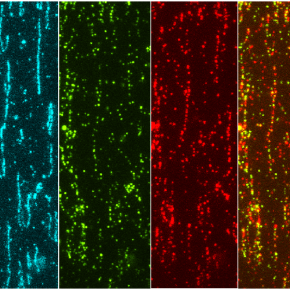
Le LPCA participe à une étude caractérisant les interactions entre ADN et protéines
Forts de leur expertise en microscopie, en analyse d'images, en acoustique et en biophysique, des scientifiques du laboratoire clermontois ont mis en œuvre une série de techniques permettant de caractériser les interactions entre l’ADN et le variant pathologique d’une protéine de maintenance de l’ADN mitochondrial. Un travail contribuant à faire la lumière sur l’origine de certains troubles visuels.
Dans un travail récent, une équipe du LPCA, en collaboration avec des équipes de l’Université Paris-Saclay, de l’Université de Göteborg (Suède) et de l’Institut de Biologie Moléculaire de Barcelone (Espagne), ont étudié une mutation pathogénique d’une protéine cruciale pour la copie du génome des mitochondries, ces compartiments cellulaires responsables de la production d’énergie. La mutation de cette protéine, nommée mtSSB, est notamment responsable de troubles visuels.
Le LPCA disposant d’une expertise forte en microscopie, analyse d’images, acoustique et biophysique, les scientifiques IN2P3 ont joué un rôle clé dans la mise en œuvre de la technique dite de microscopie de fluorescence par réflexion totale interne (microscopie TIRF) en choisissant, entre autres, les lasers, les filtres et les caméras du setup expérimental. Une méthode qui a permis aux biologistes de directement visualiser in vitro, sur des molécules d’ADN attachées à une lame de microscopie, la protéine normale ou mutée marquée par un fluorophore. En outre, l’équipe du LPCA a optimisé le setup de la spectroscopie de force acoustique (AFS), une technique par laquelle une bille micrométrique manipulée par une force acoustique sonde la matière au niveau moléculaire. L’AFS a ici permis de révéler l’impact de la liaison des protéines sur la longueur apparente et la rigidité de l’ADN.
Le recours à ce panel d’approches biophysiques innovantes par les équipes de physiciens et de biologistes a permis de montrer que le variant pathologique de la protéine étudiée compacte moins bien l’ADN et se lie à l’ADN de manière instable. Ces résultats participent à une meilleure compréhension des mécanismes moléculaires à l’origine de la pathologie – ils ont été publiés dans le journal Nucleic Acids Research.